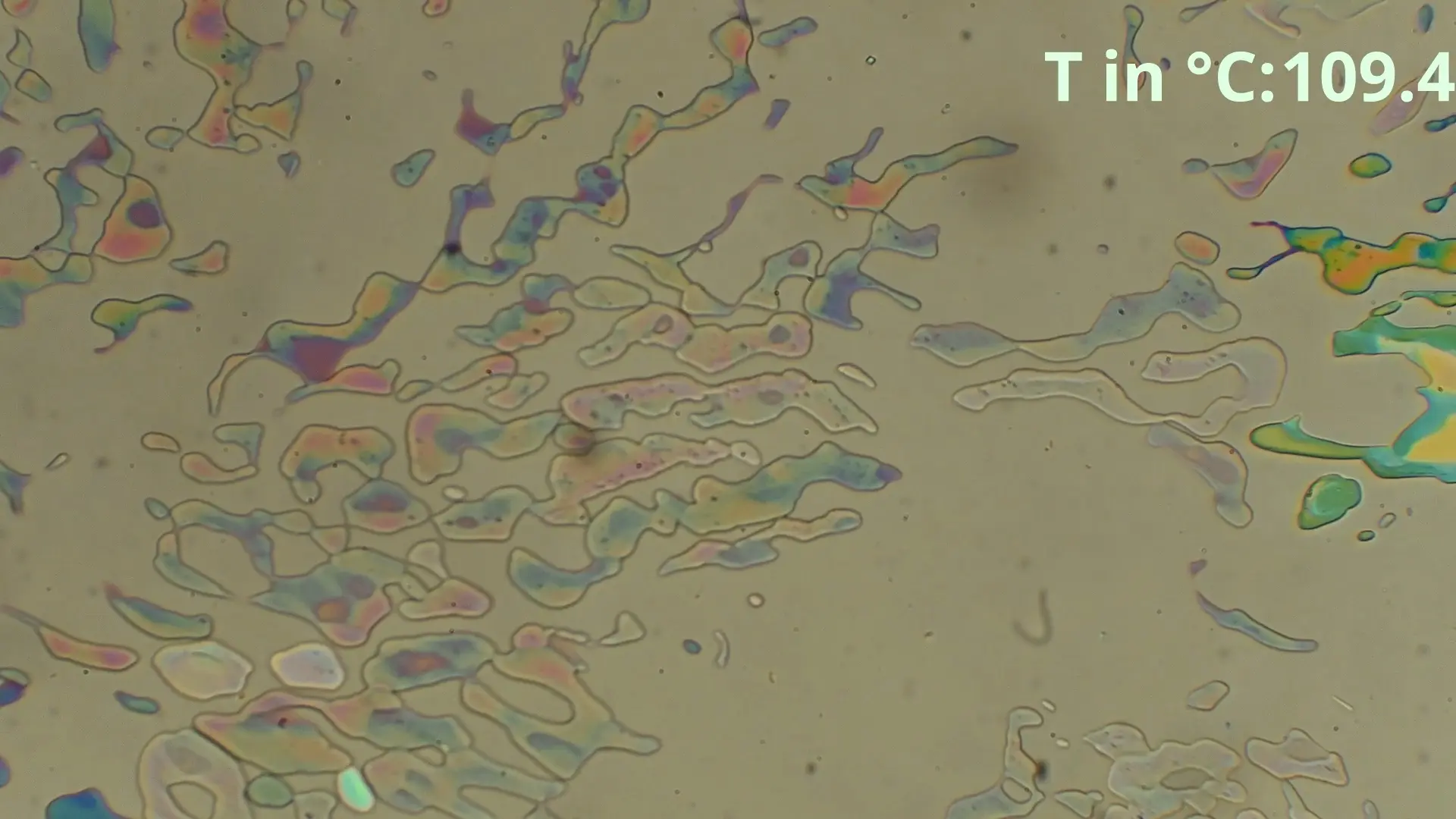
Untersuchung des Reinstoffes Benzamid




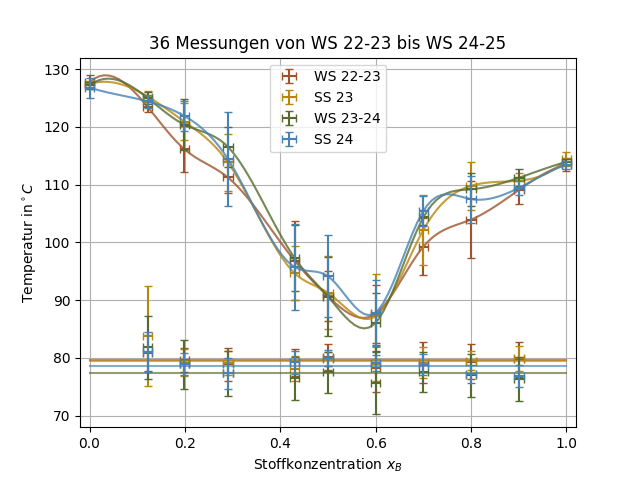
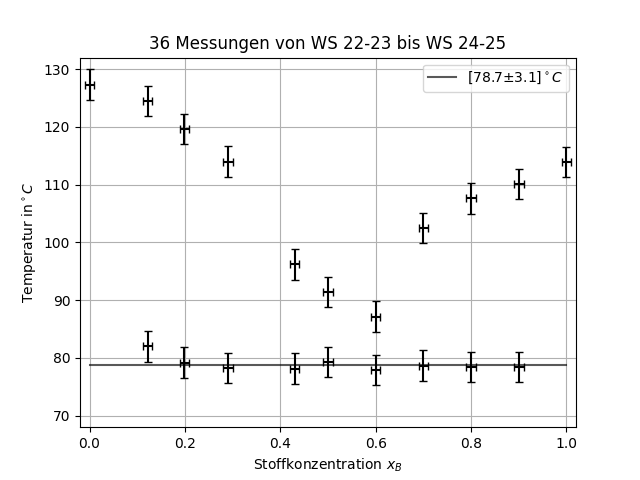
Grundsätzlich wird das Schmelzverhalten von verschiedenen Konzentrationen eines binären Systems untersucht. Dazu wird ein Mikroskop mit Heizfunktion und Polarisator genutzt, die verschiedenen Gemische langsam erhitzt und dabei beobachtet.
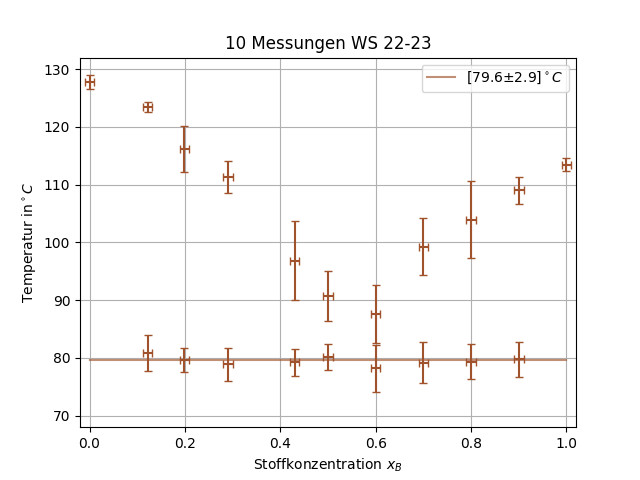
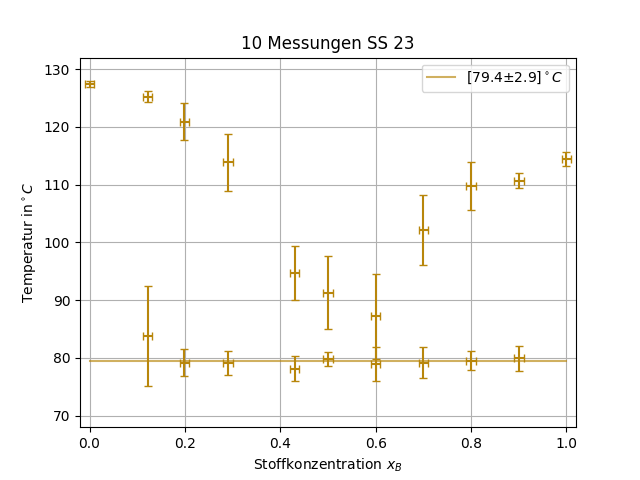
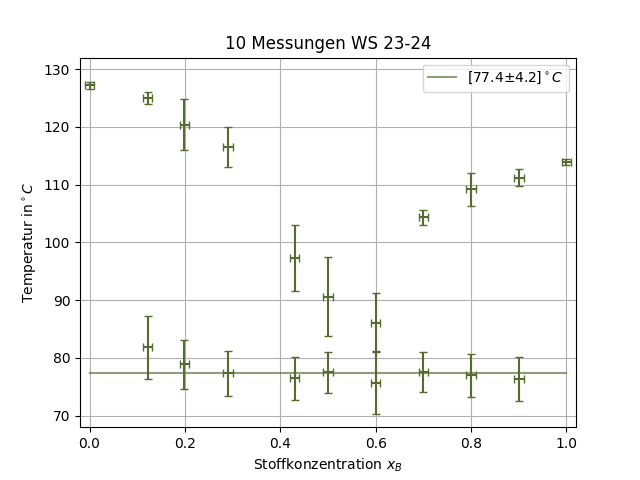
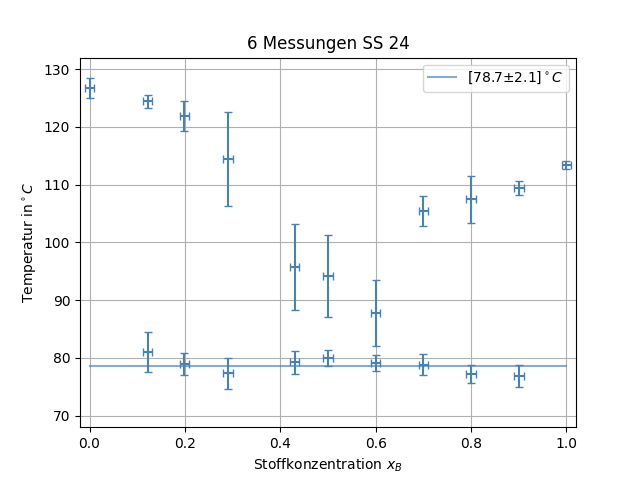
Die Werte für die untere und obere Schmelztemperatur werden dabei gegen die Konzentration aufgetragen um Liquiduskurven sowie die Eutektikale zu erhalten. Diese Kurven sind charakteristische Eigenschaften des Systems und für die Herstellung von Legierungen, Medikamenten und vielerlei anderer Prozesse relevant.





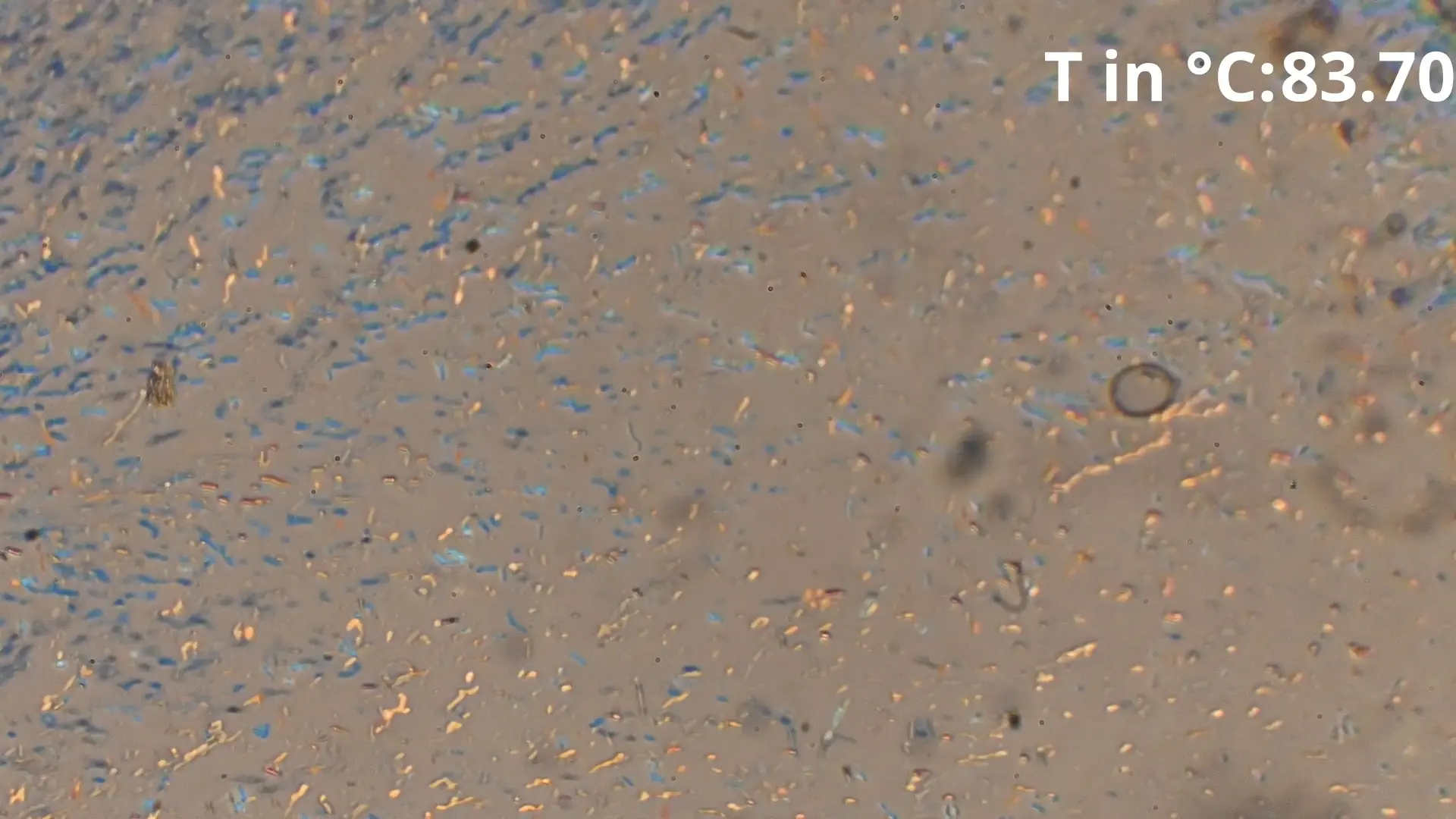
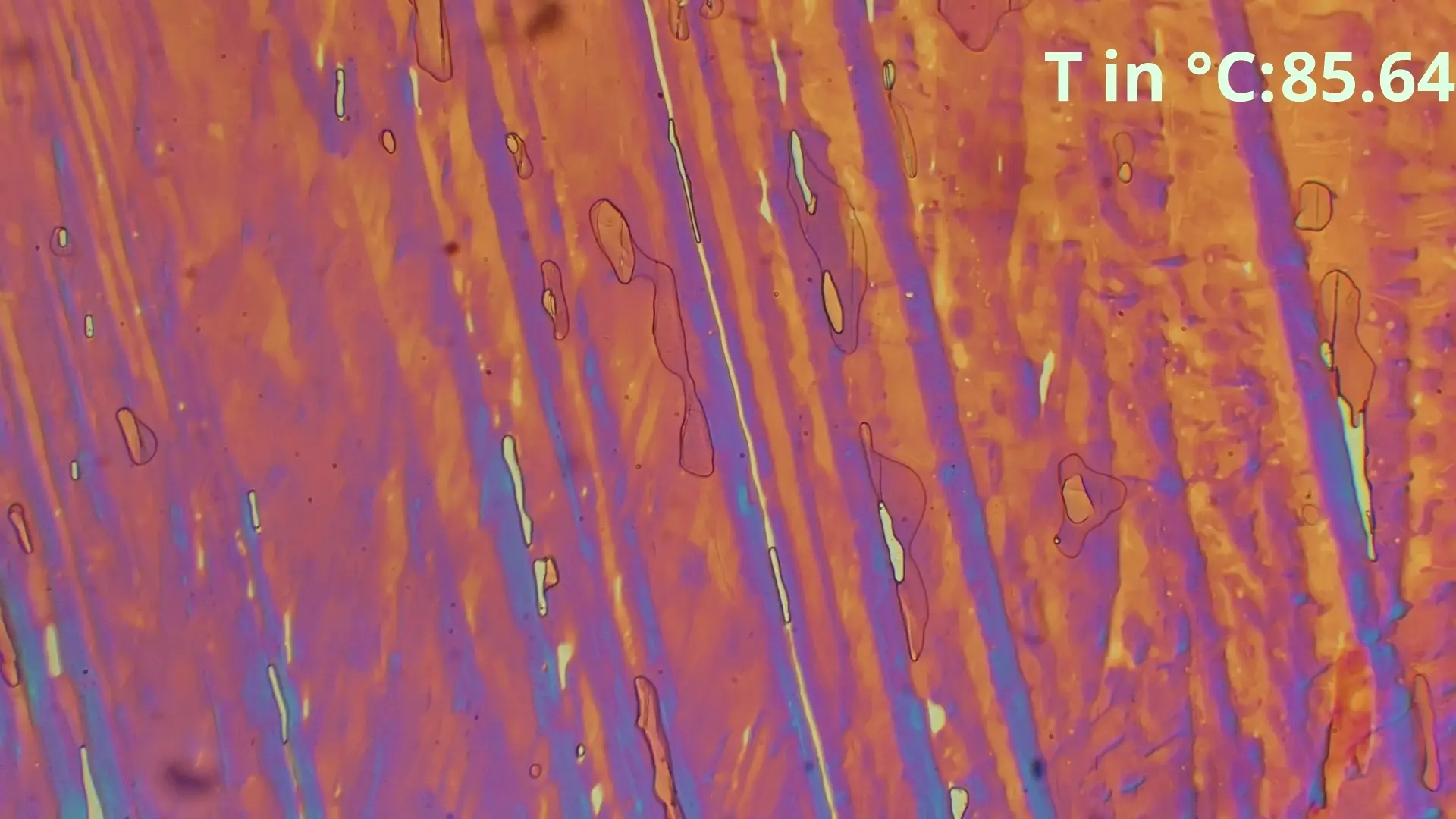
0.52 Acetanilid 0.48 Benzamid Eutektikale
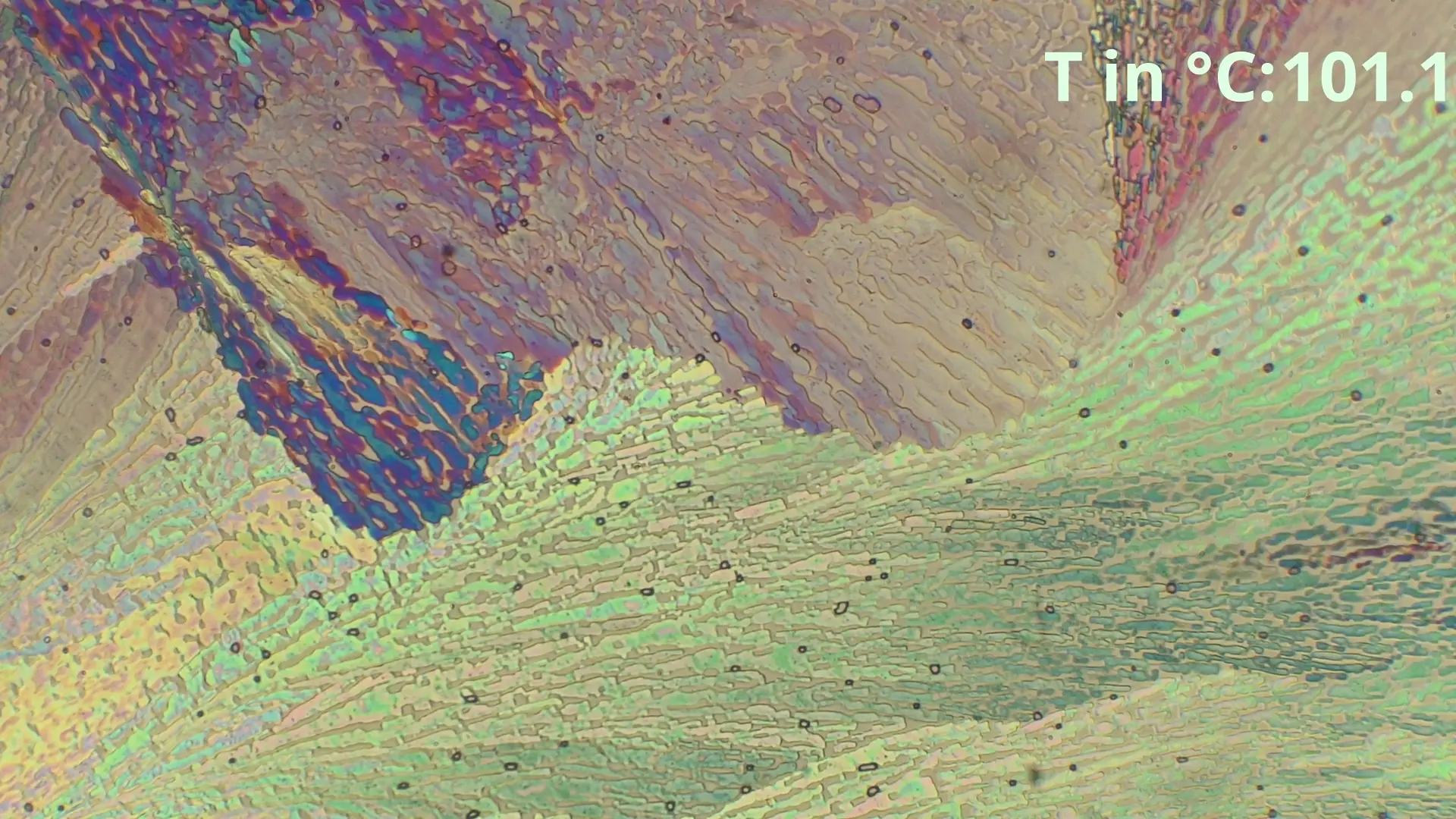
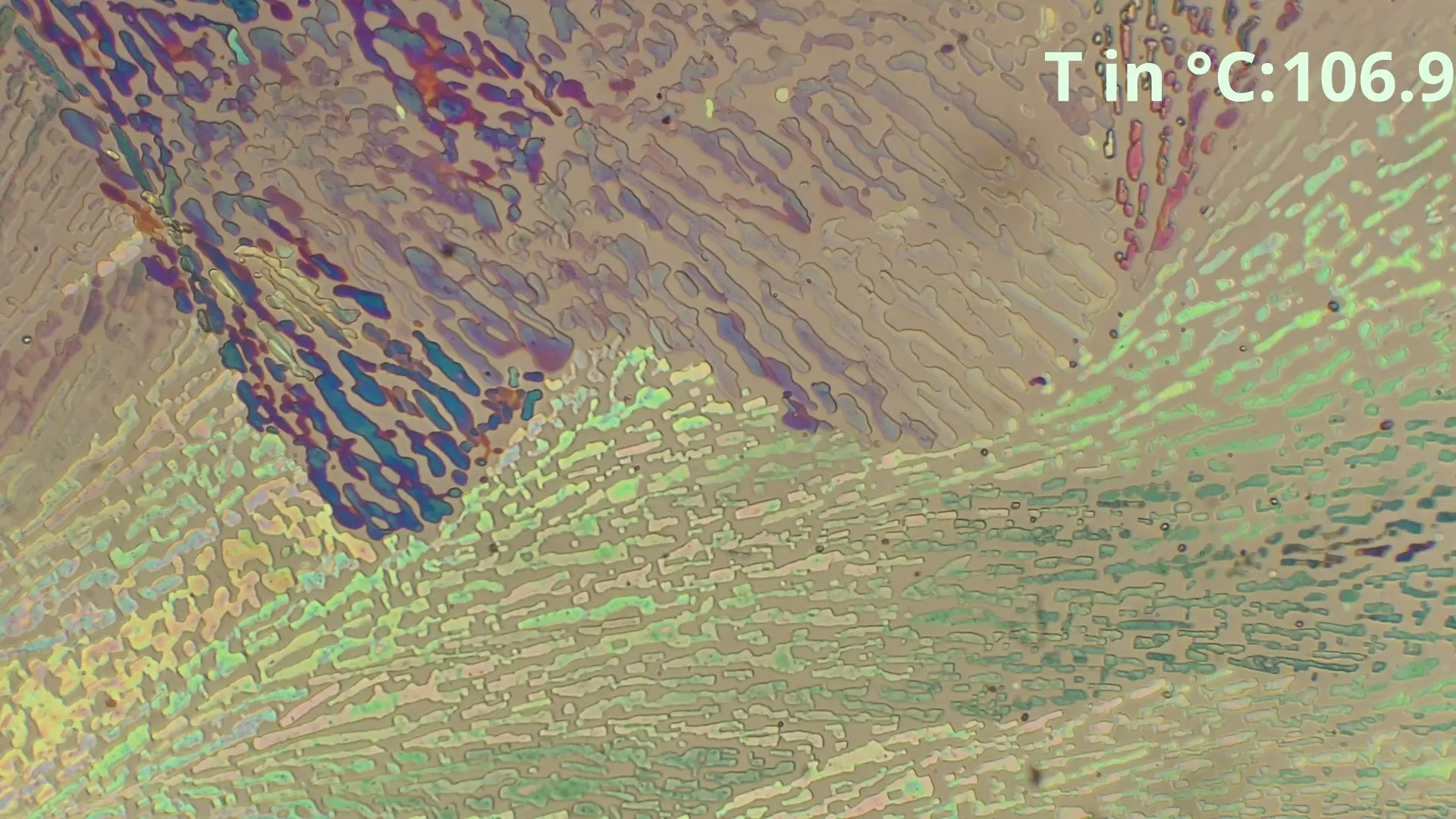
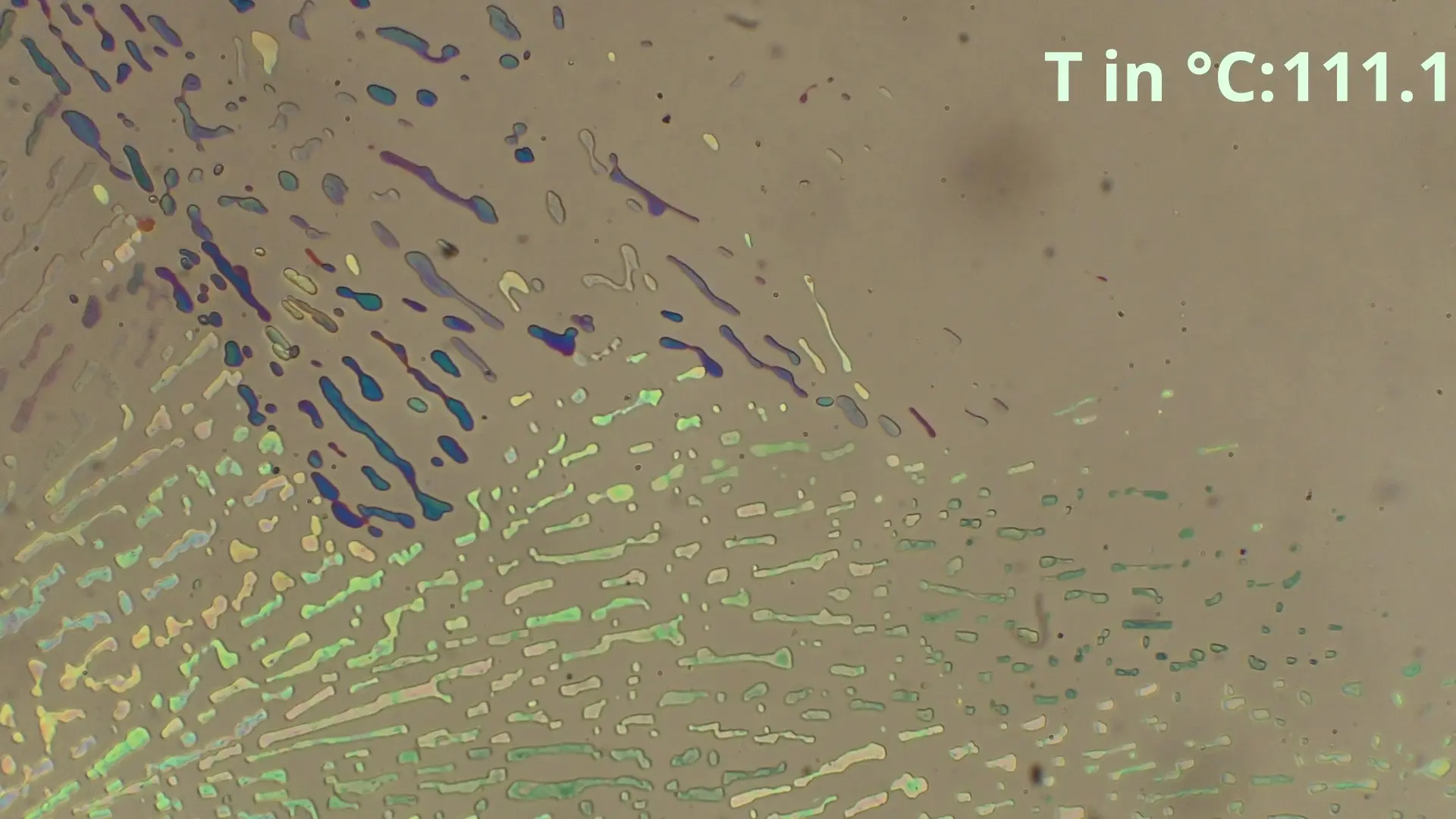
Hier ist zu sehen, wie die eutektische Zusammensetzung von 48% Benzamid und 52% Acetanilid zwischen in diesem Fall 85-86°C schlagartig schmilzt und eine geringe Menge von Acetanilid
übrig bleibt, welche langsam weiter geschmolzen wird.
Diese spontane Schmelzung ist der beste Indikator für das Erreichen
der Eutektikalen. Bei größeren Differenzen der Anteile ist der spontan schmelzende Anteil geringer, sodass nur leichte Bläschenbildung oder eine langsame Farbänderung sichtbar ist.